Білки. Амінокислоти як мономери білків
Білки - біополімери, мономерами яких є амінокислоти. Молекули білків представляють собою лінійну структуру, утворену з довгого ланцюга амінокислот. Молекули білків дуже великі; вони являють собою макромолекули, молекулярна маса яких коливається від кількох тисяч до кількох мільйонів.
В тканинах і клітинах зустрічаються більше 170 різноманітних амінокислот, однак звичними компонентами білків можна вважати лише 20 амінокислот.
 |
| Загальна формула амінокислоти |
Як вже було зазначено вище, молекули білків будуються із з'єднаних одна з одною амінокислот. З'єднання відбувається завдяки утворенню пептидного зв'язку.
 |
| Утворення пептидного зв'язку (натисніть для збільшення) |
Білкова молекула, яка утворилась потім згортається і приймає властиву їй форму завдяки утворенню чотирьох інших видів зв'язків - іонних, дисульфідних, водневих зв'язків і гідрофобних взаємодій.
Рівні структурної організації білків
Кожному білку властива своя особлива геометрична форма, або конформація. Для опису тривимірної структури білків розглядають зазвичай чотири рівні організації.
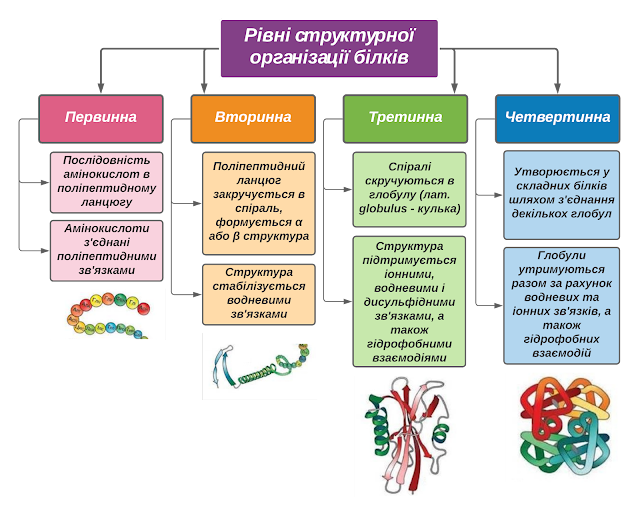 |
| Рівні структурної організації білків (натисніть для збільшення) |
При різкій зміні оптимальних для білка умов він піддається денатурації. Під денатурацією розуміють втрату тривимірної конформації, властивій даній білковій молекулі. Ця зміна може носити тимчасовий або постійний характер, але і в тому, і в іншому випадку амінокислотна послідовність білка залишається незмінною. При денатурації молекула розгортається і втрачає здатність виконувати свою звичайну біологічну функцію. Викликати денатурацію білків можуть різноманітні чинники:
- нагрівання;
- опромінювання;
- сильні кислоти; луги;
- концентровані розчини солей;
- важкі метали.
Іноді денатурований білок у відповідних умовах знову спонтанно набуває свою нативну структуру. Цей процес називається ренатурацією.
При тривалій термічній обробці зміни білків не обмежуються їх денатурацією. Для доведення продукту до повної готовності необхідно нагрівати його при температурах, близьких до 100 ° С, більш-менш тривалий час. У цих умовах білки піддаються подальшим змінам, пов'язаним з руйнуванням їх макромолекул - деструкція (піддається зміні первинна структура).
Основні біологічні функції білків
 |
| Натисни для збільшення |
Ферменти, їх властивості та принципи функціонування
Ферменти - це білкові молекули, що синтезуються живими клітинами. В кожній клітині містяться сотні різноманітних ферментів. З їх допомогою здійснюються численні хімічні реакції, які можуть з великою швидкістю йти за температур, що підходять для даного організму, тобто в межах від 5 до 40°С. Щоб ці реакції з тією ж швидкістю протікали за межами організму, були б необхідні високі температури та різкі зміни інших умов. Для клітини це значили б загибель. Таким чином ферменти можна визначити як біологічні каталізатори.
Ферменти характеризуються наступними основними властивостями:
- всі ферменти глобулярні білки;
- вони збільшують швидкість хімічних реакцій, однак самі в цих реакціях не витрачаються;
- їх присутність не впливає ні на природу, ні на властивості кінцевого продукту реакції;
- дуже мала кількість ферменту викликає перетворення великих кількостей субстрату;
- активність ферменту змінюється в залежності від рН, температури, тиску и концентрацій як субстрату, так і самого ферменту;
- реакція, що каталізується, оборотна;
- ферменти володіють специфічністю, тобто один фермент каталізує зазвичай тільки одну реакцію.
Нуклеїнові кислоти
Нуклеїнові кислоти являють собою генетичний матеріал всіх живих організмів аж до найпростіших вірусів. Назва «нуклеїнові кислоти» відображає той факт, що локалізуються вони головним чином в ядрі (nucleus - ядро).
Нуклеїнові кислоти складаються з мономерних одиниць - нуклеотидів. З нуклеотидів будуються надзвичайно довгі молекули - полінуклеотіди.
Отже нуклеїнові кислоти - складні високомолекулярні біополімери, побудовані з нуклеотидів, які в усіх живих організмах виконують роль збереження, передачі й реалізації спадкової інформації.
Молекула нуклеотиду складається з трьох частин:
- цукор (моносахарид, пентоза)
- нітратна (нітрогенвмісна) основа
- фосфорна кислота
ЦУКОР, що входить до складу нуклеотиду, містить п'ять атомів вуглецю, тобто представляє собою пентозу. Залежно від виду пентози, присутньої в нуклеотиді, розрізняють два типи нуклеїнових кислот - рибонуклеїнові кислот (РНК), які містять рибозу, та дезоксирибонуклеїнові кислоти (ДНК), що містять дезоксирибозу.
ФОСФОРНА КИСЛОТА надає кислих властивостей нуклеїновим кислотам.
 |
| Будова нуклеотиду |
Нуклеїнові кислоти, подібно білкам, володіють первинною структурою (під якою розуміють їх нуклеотидну послідовність) і тривимірною структурою.
ДНК - подвійна правозакручена спіральна молекула. Відстань між нуклеотидами (або довжина нуклеотиду) становить 0,34 нм, крок спіралі – 3,4 нм і містить 10 пар нуклеотидів, діаметр спіралі (2 нм) сталий по всій довжині.Спіраль молекули ДНК складається з дезоксирибонуклеотидів, в утворенні яких беруть участь: азотисті основи аденін, тимін, гуанін і цитозин, моносахарид дезоксирибоза і залишки ортофосфатної кислоти. Мономери ДНК поділяють на 4 типи: аденілові, тимідилові, гуанілові й цитиділові. Нуклеотиди в одному ланцюзі з’єднані міцними ковалентними (фосфодіестерними) зв’язками, а нуклеотиди з різних ланцюгів у молекулах ДНК з’єднуються між собою за допомогою водневих зв’язків на основі принципу комплементарності (А = Т, Г = Ц).
 |
| Структура молекули ДНК та принцип комплементарності |
Процес самоподвоєння ДНК, який забезпечує точне копіювання спадкової інформації і передачу її з покоління в покоління, називається реплікацією (від англ. replication – копіювання).
Репарація (від англ. DNA repair – «ремонт» ДНК) – сукупність процесів, за допомогою яких виправляються пошкодження молекул.
Ще однією властивістю ДНК є здатність до денатурації (втрата молекулою ДНК спіральної структури внаслідок розриву водневих зв’язків між комплементарними азотистими основами) і ренатурації (відновлення двоспіральної структури завдяки встановленню водневих зв’язків між комплементарними азотистими основами).
РНК побудована з рибонуклеотидів, в утворенні яких беруть участь азотисті основи аденін, гуанін, цитозин і урацил, моносахарид рибоза та залишки ортофосфатної кислоти. Виокремлюють 4 типи рибонуклеотидів (аденілові, уридилові, гуанілові й цитиділові), що поєднуються в одинарний ланцюг за допомогою ковалентних зв’язків.
Відмінності РНК від ДНК:
- вуглеводом РНК є рибоза;
- РНК не містить тиміну, його місце займає урацил;
- РНК є одноланцюговою молекулою;
- РНК завжди мають менші довжину й молекулярну масу, оскільки є копіями окремих ділянок ДНК
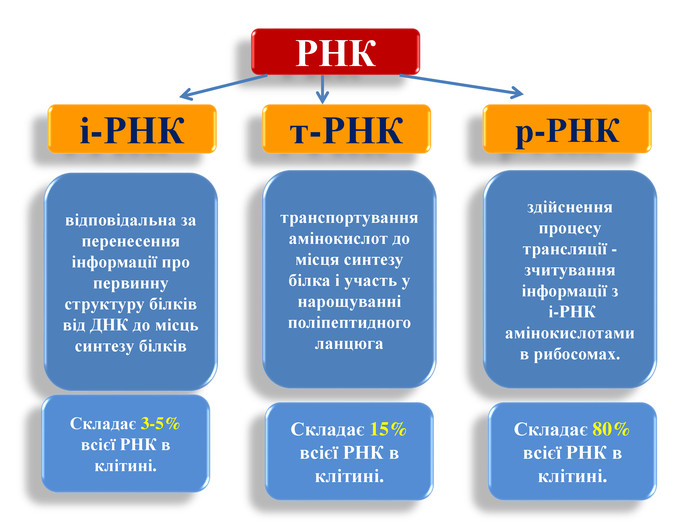 |
| Типи РНК (джерело: https://naurok.com.ua/prezentaciya-na-temu-transkripciya-rizni-tipi-rnk-genetichniy-kod-biosintez-bilka-74990.html) |
АТФ. Роль АТФ в енергозабезпеченні
 |
| Будова молекули АТФ |
- АТФ + H2O = АДФ + H3PO4 + E (40 кДж)
- АДФ + H2O = АМФ + H3PO4 + E (40 кДж)

Немає коментарів:
Дописати коментар